Autor:
Mark S. Rea
Kurzfassung
Der Beitrag gibt einen Überblick über den Einfluss von Licht auf das circadiane System und unterstreicht die Bedeutung der Entwicklung eines Rahmenwerkes zu einer circadian-basierten Lichtbewertung. Die Quantität des Lichts, seine spektrale Zusammensetzung, räumliche Verteilung und der Zeitpunkt und Dauer für das Sehen sind derart unterschiedlich von den Anforderungen, die sich aus circadianen Funktionsweisen ergeben, dass man künftig allgemeine Empfehlungen über „gutes Licht“ nach zwei Kriteriensätzen treffen muss. Obwohl die in diesem Beitrag beschriebenen Erkenntnisse mit Sicherheit durch neue Forschungsarbeiten vertieft werden, wird der Fortschritt für die Gesellschaft nur gering bleiben, bis Wissenschaftler und Praktiker anfangen, die grundlegenden Eigenschaften von Licht sowohl nach den relevanten Aspekten für das circadiane System als auch für das visuelle System zu betrachten, messen, berechnen und steuern. Es ist mein tiefster Glaube, dass ein neues System für Photometrie auf der Basis des circadianen Systems entwickelt werden muss, und, dass wir bis zu dessen Realisierung unfähig sein werden, Behauptungen über „gutes Licht“ in Bezug auf die menschliche Gesundheit aufzustellen.
Beitrag
EINLEITUNG
Übersetzung eines Vortragsmanuskriptes, wiedergegeben mit Genehmigung des Autors (Original verfügbar unter http://www.lrc.rpi.edu/programs/lightHealth/pdf/moreThanVision.pdf)
Obwohl die Themen dieses Symposiums optische Strahlung umfassen, werde ich meine Betrachtungen auf den engeren Bereich beschränken, der als „Licht“ bezeichnet wird. Genauer gesagt, werde ich meine Ausführungen auf den Einfluss von Licht auf circadiane Funktionen begrenzen, weil ich glaube, dass wir uns an der Schwelle eines neuen Paradigmas für Beleuchtungstechnologien und -anwendungen befinden, da sich diese auf das Gesundheit des Menschen auswirken.
Licht ist derzeit formal definiert als die in das Auge eintreffende optische Strahlung, die eine Sehempfindung hervorruft [1]. Es wurde ein internationales photometrisches System entwickelt und eingeführt, um die auf das Sehen bezogenen Eigenschaften von Licht zu quantifizieren, zu messen und zu übermitteln [2]. Gemeinsam mit dieser Photometrie haben sich mächtige produktions- und Anwendungsindustrien entwickelt, die nahezu jeden Menschen auf dem Planeten mit praktisch nutzbaren Lichtquellen versorgen, um gedruckte Information zu lesen, selbstleuchtende Anzeigen zu betrachten, Autos zu fahren bzw. andere Verkehrsmittel zu benutzen, und unzählige Sportarten sowohl in Räumen als auch im Freien zu betreiben[1].
Betrachtet man die Forschungsergebnisse der letzten 25 Jahre, glaube ich allerdings, dass wir zur unweigerlichen Schlussfolgerung kommen, dass wir die Definition von Licht erweitern müssen, um die optische Strahlung, die über das Auge das circadiane System beeinflusst, einzuschließen. In der Tat glaube ich, dass bei der Beleuchtung jetzt die aufregendste Zeit seit 100 Jahren gekommen ist, da unsere unbedachten und unreflektierten Annahmen über „gutes Licht“ durch diese Forschungsergebnisse in Frage gestellt werden. Dies ist eine in starken Worten gefasste Feststellung, aber bedenken Sie bitte die folgenden neueren Erkenntnisse:
• Licht kann Winterdepression mildern [3]
• Licht kann die Dauer und Tiefe sowie Qualität von Schlaf erhöhen [4]
• Licht kann den Schlaf-/Wachrhythmus von Alzheimerpatienten regulieren [5]
• Licht kann die Leistungsfähigkeit von Nacht- und Schichtarbeitern erhöhen [6,7]
• Licht kann die Gewichtszunahme von Frühgeborenen verbessern [8,9]
• Die Aktivierung des circadianen Systems wird durch ein jüngst entdecktes Wahrnehmungssystem geregelt [10,11]
• Licht reguliert den Melatoninpegel [12], von dem nachgewiesen wurde, dass er das Wachstum von Brustkrebs verringert [13,14]
• Licht beeinflusst die Hirnrindenaktivität direkt [15]
Die angeführten Studien stellen nur wenige der wichtigen Forschungsergebnissen dar, die eine Antwort auf die Frage fordern: „Stellen wir gesundes Licht in unseren Büros, Schulen und Wohnungen zur Verfügung?“
Manche von uns Teilnehmern dieses Symposiums befassen sich seit Jahren mit traditioneller Beleuchtung. Wir verstehen, wie Licht erzeugt, geliefert, erstellt und verkauft wird. Ich bin sicher, dass die Beiträge dieses Symposiums uns inspirieren werden, neue Gedanken über Licht zu entwickeln. Im Idealfall werden wir anfangen, die aus diesen Beiträgen gewonnenen Erkenntnisse in praktische Ideen für neue Lichtquellen, Leuchten und Anwendungen umzusetzen. Um bei dieser Umsetzung erfolgreich zu sein, müssen wir jedoch die Fähigkeit entwickeln, dem Licht selber mit einem völlig neuen Verständnis zu begegnen. Insbesondere müssen wir über eine vollkommen neue Art der Lichtmessung bzw. Photometrie nachdenken, weil die Quantität, das Spektrum, die räumliche Verteilung, der Zeitpunkt und die Dauer der Lichteinwirkung für die circadiane Beeinflussung völlig anders sind als die, die für das Sehen wichtig sind [16]. Ein Ziel dieses Vortrags ist, einen Rahmen für ein neues photometrisches System für das circadiane System zu geben, mit dessen Hilfe man Licht zur Unterstützung menschlicher Gesundheit präziser definieren und steuern kann. Ohne die Aufstellung eines solchen Systems wird es viel schwieriger sein, die bestmöglichen Beleuchtungstechnologien und -Anwendungen im Sinne menschlicher Gesundheit zu entwickeln.
Hintergrund
Es war seit Jahren bekannt, dass der Wechsel von Lichtbestrahlung für die Steuerung des Tageszeit- und Jahreszeit-bezogenen Verhaltens von Säugetieren außer Menschen bedeutsam ist [17,18]. Jedoch wurde allgemein angenommen, dass Menschen nicht besonders empfindlich für wechselnde Lichteinflüsse seien. Wie oben erwähnt, wurde in den letzten 30 Jahren klar, dass Hell/Dunkel-Zyklen auch viele Verhaltensweisen des Menschen steuern, einschließlich Winterdepression [3], Schlaf-/Wach-Rhythmen [19], Körpertemperatur [15], Hirnaktivitäten [15], subjektiver Wachsamkeit [20] und Leistungsfähigkeit [6, 7].
Es gilt derzeit als gesichert, dass die Netzhaut für die Umsetzung der photopischen Erregung in neuronale Signale für das circadiane System verantwortlich ist [18, 21 – 26]. Kurz ausgedrückt, der retinohypothalamische Trakt (RHT) überträgt diese neuronale Information von der Netzhaut zur „biologischen Hauptuhr“ in den suprachiasmatischen Nucleus (SCN) des Hypothalamus. Der SCN generiert einen endogenen Rhythmus der neuronalen Aktivität von (etwa) 24 Stunden Dauer. Das Hormon Melatonin wird von der Zirbeldrüse ausgeschüttet, dem Primärenziel für neuronale Eingangssignale vom SCN [27]. Obwohl noch nicht alle Wirkungsweisen des Melatonin im menschlichen Körper bekannt sind, weiß man, dass der Melatoninspiegel im Blut (oder im Speichel oder Urin) der Hauptindikator für den Zustand der „biologischen Hauptuhr“ (Phaseninformation) und für die circadiane Einwirkung (akute Suppression) von Licht ist (s. z.B. Lewy et al. [12]). Licht ist der Primärerreger für die Steuerung, durch den SCN, Timing und Menge vom Melatonin, erzeugt in der Zirbeldrüse [28], und vermutlich auch dessen Auswirkungen auf einheitliche Verhaltensweisen wie subjektive Wachsamkeit oder Leistungsfähigkeit.
Obwohl es klar ist, dass Licht den primären Reiz für das circadiane System liefert, sind die für das circadiane System wichtigen Charakteristika des Lichts (d.h. Quantität, Spektrum, Verteilung, Timing und Dauer) mehrdeutig, u.a. deswegen, weil kein ernst zu nehmender Versuch unternommen worden ist, ein photometrisches System hierfür zu schaffen. Beispielsweise war man früher überzeugt, dass helles Licht notwendig war, um das circadiane System zu beeinflussen, und dies sowohl für die akute Melatoninsuppression in der Nacht als auch bezüglich der Phaseninformation vom SCN. Übliche Beleuchtungsstärkeniveaus für Büros (500 lx), erzeugt mit Leuchtstofflampen, sind nachweislich unwirksam für die Melatoninsuppression [12]. In jüngerer Zeit wurde hypothetisch behauptet, dass sehr niedrige Niveaus (3,5 lx) das circadiane System beeinflussen können [29]. Es scheint sehr abwegig zu sein, dass es zu derart radikal unterschiedlichen Verallgemeinerungen über die Menge des zur Beeinflussung des circadianen Systems erforderlichen Lichts kommen kann. Wenn man aber zwei simple Beobachtungen berücksichtigt, wie Licht charakterisiert wird, wird es klarer, warum die Antwort auf eine so simple Frage „Wie viel Licht benötigt man zur Beeinflussung des circadianen Systems?“ mehrdeutig ausfällt.
Erstens, die Lichtmenge wird in dieser und in vielen anderen Studien als Beleuchtungsstärke (lx) gemessen. Die Nutzung dieser Größe für die die Kennzeichnung von Licht beruht zweifelsfrei auf der breiten Verfügbarkeit preiswerter handelsüblicher Geräte zur Beleuchtungsstärkemessung. All diese Messgeräte sind an die spektrale Hellempfindlichkeitsfunktion des Auges für den photopischen Bereich angepasst, die auf der spektralen Empfindlichkeitsverteilung der L- und M-Zapfen der menschlichen Netzhaut beruht. Da diese beiden Empfänger im Wesentlichen irrelevant für die circadiane Phototransduktion (Signalweitergabe) sind [30, 31], werden erhebliche Abweichungen auftreten, wenn die Menge des in den Studien durch unterschiedliche Lichtquellen produzierten Lichts durch eine spektrale Empfindlichkeitsfunktion gekennzeichnet wird, die für das circadiane System irrelevant ist. Wie weiter unten ausführlicher diskutiert wird, können bei Lichtquellen, die üblicherweise für Büros, Schulen und Wohnräumen genutzt werden, Fehler bei der spektralen Kennzeichnung des Lichts für das circadiane System in der Größenordnung von 3:1 auftreten. In anderen Worten, bei der gleichen gemessenen Beleuchtungsstärke kann sich die Wirkung zweier Lichtquellen auf das circadiane System um den Faktor drei unterscheiden. Bei eher exotischen Lichtquellen wie LEDs kann der Fehler über 1000:1 liegen.
Zweitens ist die Beleuchtungsstärke die Lichtmenge, die auf eine Fläche fällt, und nicht die Quantität des Lichts, die auf der Netzhaut auftrifft. Je nach Aufstellung und Ausrichtung des Beleuchtungsstärkemessgeräts, horizontal auf der Arbeitsebene oder vertikal in der Nähe der Ebene der Netzhaut, kann die gleiche Menge von Licht, das von einer Lichtquelle emittiert wird, in der Messung der Beleuchtungsstärke einen um den Faktor 30 unterschiedlichen Wert ergeben. Üblicherweise werden empfohlene und gemessene Beleuchtungsstärkeniveaus auf der horizontal ausgerichteten Arbeitsebene angegeben [1]. Naturgemäß wird das Messgerät bei einer Ausrichtung in Richtung zur Decke mehr anzeigen als bei vertikalen Ausrichtung in Nähe der Blickrichtung. Aber auch eine an der Blickrichtung orientierte Messung garantiert nicht notwendigerweise eine richtige Messung der Lichtmenge, die tatsächlich in das Auge eintritt. Bei gleicher Beleuchtungsstärke kann die Lichtmenge auf der Netzhaut auf Grund persönlicher und Umwelt bezogener Faktoren erheblich unterschiedlich ausfallen. Beispielsweise werden unterschiedliche Reflexionsgrade von Sehobjekten im Gesichtsfeld, die optische Dichte von der Retina vorgelagerten Teile des Auges (z.B. die der Augenlinse) und die physikalischen Eigenschaften der Augenbrauen, der Nase und anderer Teile des Gesichts für erhebliche Diskrepanzen zwischen der tatsächlich auf der Netzhaut vorhandenen Beleuchtungsstärke und der gemessenen Beleuchtungsstärke sorgen [32].
Dies sind nur zwei der vielen Quellen der Konfusion, die sich aus der nicht angemessenen Beschreibung des Reizes für das circadiane System ergeben, und unterstreicht die Schwierigkeiten, mit denen sich Hersteller von Lichtsystemen und Lichtplaner konfrontiert sehen, wenn sie Forschungsergebnisse im Sinne einer Förderung der menschlichen Gesundheit umsetzen wollen. Kurz gesagt, wir müssen alle physikalischen Charakteristika von Licht erneut bewerten, wenn wir die Hürde nehmen wollen, die sich vor der Realisierung gesunder Lichtbedingungen aufbaut.
Quantität
Die durchgezogene Kurve in Abb. 1 (linke Seite) [16] leitet sich aus dem Modell für relative Sehleistung (RVP) von Rea und Ouelette [33] ab und beschreibt die Geschwindigkeit und Genauigkeit der Verarbeitung von alphanumerischem Text mit hohem Kontrast durch die Fovea von jungen Erwachsenen. Selbst bei Mondlicht ist die Sehleistung über dem Schwellenwert, undhöhere Beleuchtungsniveaus führen, wie dargestellt, nur zu geringfügigen Verbesserungen. Wie viele Studien bestätigt haben [34 – 36], liegt die Sehleistung bei in Büro üblichen Beleuchtungsstärkeniveaus in der Nähe ihres Maximums (für Objekte mit hohem Kontrast und Größe). Abb. 1 zeigt auch, wie das Beleuchtungsniveau die Melatoninsuppression durch das circadiane System beeinflusst. Die gestrichelte Kurve rechts zeigt eine Dosis-Wirkungs-Beziehung für weißes Licht („Vollspektrumlicht“) mit einer Expositionszeit von einer Stunde in der Nachtzeit, wo die Melatoninkonzentration üblicherweise hoch ist [37]. Mehrere Studien stimmen mit dieser Dosis-Wirkungs-Beziehung überein [30, 38 – 43], wenn man die weiteren photometrischen Größen (Spektrum, Verteilung, Timing und Dauer) einbezieht.

Abb. 1 Relative Sehleistung für Lesematerial mit hohem Kontrast und die relative Melatoninsuppression als Funktion der Beleuchtungsstärke auf dem Auge.
Was diese Abbildung offen legt, ist die offensichtliche Ungleichheit der Quantitäten, die erforderlich sind, eine akzeptable Sehleistung einerseits und eine akzeptable Melatoninsuppression andererseits zu erzielen. Bei üblichen Beleuchtungsniveaus in Büros liegt die Sehleistung in der Nähe ihres Maximums, während das circadiane System nur leicht beeinflusst wird, wenn überhaupt. Eine längere Exposition dämmerigen Lichts kann möglicherweise auch Melatonin unterdrücken und die circadiane Rhythmik verschieben [29], dies ist aber mit Sicherheit nicht der beste Weg, dem Körper tageszeitliche Information zu signalisieren. Tatsächlich kann ein verlängertes schwaches Signal sogar für die Synchronisierung von ungleich verlaufenden biologischen Funktionen, die beeinflusst von Melatonin sind, ungeeignet sein. Bezeichnenderweise können moderne Großraumbüros mit großer Raumtiefe und geringem Zugang zu Tageslicht [44] und üblichen Beleuchtungsniveaus, die nach Energiespargesichtspunkten ausgelegt worden sind [1] wenig Anreize für das circadiane System geben, insbesondere in den Wintermonaten, wenn die Verfügbarkeit von Tageslicht gering ist.. Etwa 10% der Population in den nördlichen Breitengraden erleben Winterdepression unterschiedlichen Grades [45] und dies kann eine direkte Folge des begrenzten Zugangs zu Licht sein, das heller ist als in modernen Gebäuden üblich.
Spektrum
Neueste Forschungsergebnisse haben gezeigt, dass sich die spektrale Empfindlichkeit des circadianen Systems von der der Fovea sehr stark unterscheidet, die für den größten Teil der „Seharbeit“ (z.B. Lesen) maßgeblich ist [33, 46]. Obwohl weniger als 1% der Photorezeptoren der Netzhaut in der Fovea zu finden ist [47], beschäftigen sich etwa 80% unseres visuellen Kortexes mit der Verarbeitung der Information, die in unserem Sehzentrum empfangen wird [47]. Die Fovea wird von L- und M-Zapfen dominiert, deren spektrale Empfindlichkeitsfunktion nahezu jedem käuflich erwerbbaren Photometer zu Grunde liegt [2]. Abb. 2 zeigt die große Abweichung zwischen der spektralen Reaktion von Photometern und der (vorläufigen) spektralen Empfindlichkeit des menschlichen circadianen Systems, den unabhängige Labors unter Nutzung von monochromatischem [41, 42] und breitbandigem Licht [30, 43] ermittelt haben. Diese Abbildung zeigt deutlich, dass Lichtquellen mit einem großen Anteil an kurzwelliger Strahlung (z.B. Tageslicht) bei photometrischen Messungen stark unterbewertet werden. Tabelle 1 [16] zeigt photopische und „circadiane“ Lichtströme , die für verschiedene kommerziell erhältliche Lichtquellen berechnet wurden, zusammen mit dem Verhältnis der circadianen Lichtströme zu den photopischen Lichtströmen. Diese Verhältnisse zeigen in etwa den Fehler, der bei der Bestimmung der Wirkung dieser Lichtquellen gemacht wird, wenn mit einem konventionellen Photometer gemessen wird. Beispielsweise würde das Tageslicht für das circadiane System bei gleicher photometrisch gemessener Beleuchtungsstärke 2,22 Mal (2,78 : 1,25) wirksamer sein als eine Glühlampe. Für konventionelle Lichtquellen mit weißem Licht werden die Fehler selten das Verhältnis von 3:1 überschreiten.
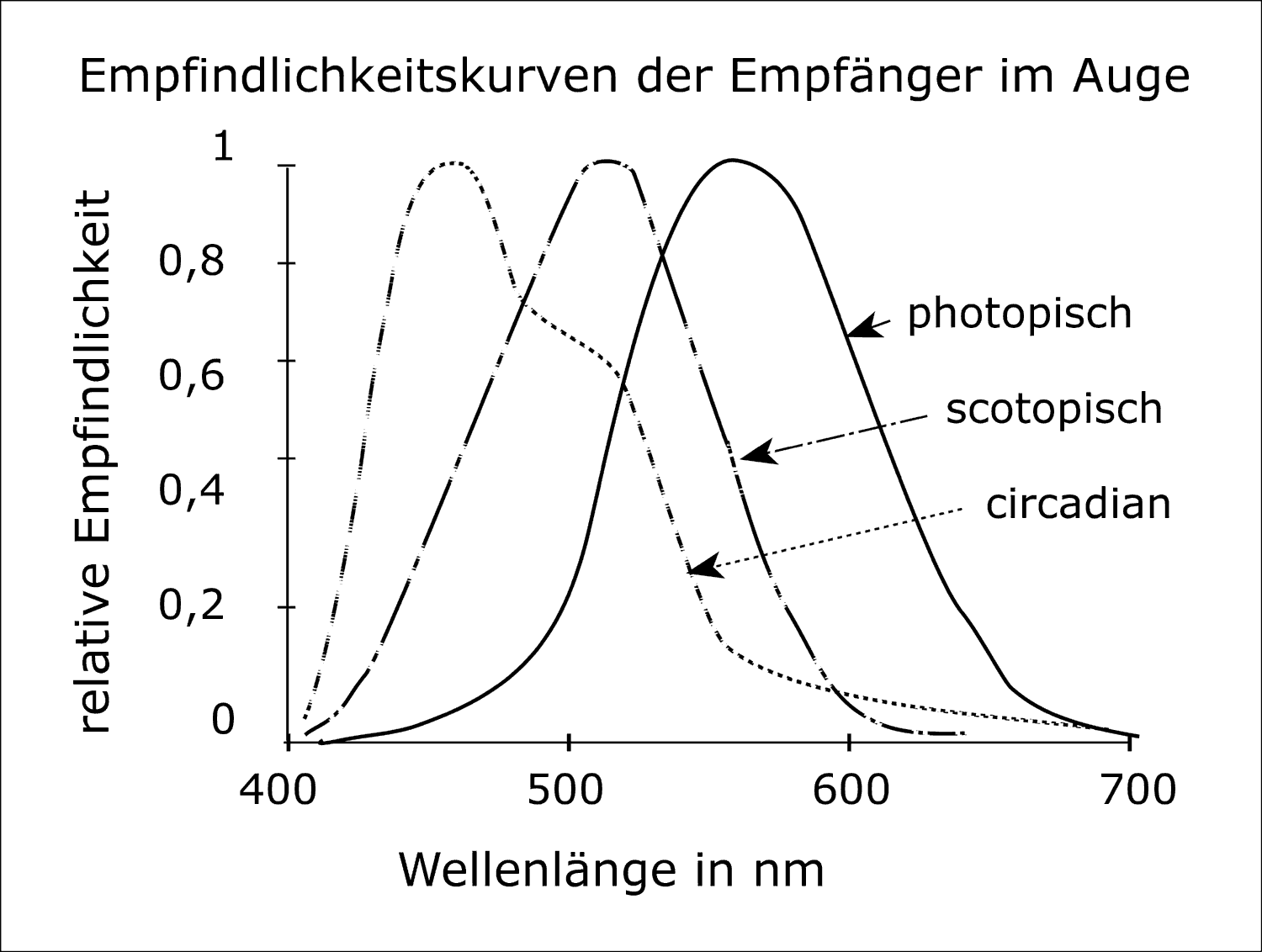
Abb. 2 Empfindlichkeitskurven für die photopische und skotopische Hellempfindlichkeit und das empirisch ermittelte Aktionsspektrum für die Melatoninsuppression.
|
Lichtquelle
|
Lichtausbeute
(photopisch) (lm/W) |
Lichtausbeute |
Verhältnis der
Lichtausbeuten (circadian/ photopisch) |
| 3000 K Leuchtstoff seltene Erden |
87 (1,00)
|
149 (1,00)
|
1,00
|
| 4100 K Leuchtstoff seltene Erden |
87 (1,00)
|
275 (1,85)
|
1,85
|
| 7500 K Leuchtstoff seltene Erden |
65 (0,75)
|
285 (1,91)
|
2,56
|
| Schwefel-scandium Metalldampf |
108 (1,24)
|
300 (2,02)
|
1,63
|
| Schwefelhochdruck |
127 (1,46)
|
115 (0,07)
|
0,53
|
| LED rot (630 nm) |
44 (0,51)
|
2 (0,02)
|
0,03
|
| LED gelb (590 nm) |
36 (0,41)
|
10 (0,07)
|
0,17
|
| LED grün (520 nm) |
25 (0,29)
|
88 (0,59)
|
2,06
|
| LED blau (460 nm) |
11 (0,13)
|
681 (4,59)
|
36,2
|
| LED weiß (460 nm + Leuchtstoff) |
18 (0,21)
|
90 (0,60)
|
2,91
|
| Tageslicht (6500 K) |
–
|
–
|
2,78
|
Tabelle 1: Photopische und „circadiane“ Lichtausbeuten (wenn anwendbar) und relative Lichtausbeuten bezogen auf eine Leuchtstofflampe mit 3000 K [16]. In der rechten Spalte ist das Verhältnis der relativen circadianen zur photopischen Lichtausbeuten dargestellt, ein Indikator für den Fehler durch die photopische Messung circadian wirksamer Größen (s. Text).
In Abb. 3 wird der Einfluss von drei unterschiedlichen weißen Lichtquellen aus Tabelle 1 (Leuchtstofflampen mit ähnlichsten Farbtemperaturen von 3000 K, 4100 K und 7500 K) auf die relative Sehleistung und auf die Melatoninsuppression dargestellt. Es sei daran erinnert, dass die photopische Hellempfindlichkeitsfunktion die kombinierte Spektralfunktion der L- und M-Zapfen in der Fovea repräsentiert. Da die Fovea der Sehleistung dient, kann eine einzige Kurve die relative Sehleistung [33, 46] für alle behandelten Spektren der Lampen repräsentieren, wenn sie als eine Funktion der photopischen Beleuchtungsstärke dargestellt wird. Da die L- und M-Zapfen keinen bedeutsamen Beitrag zu der spektralen Empfindlichkeit des circadianen Systems liefern [30, 31], muss die Melatoninsuppression [37] bei Darstellung als Funktion der photopischen Beleuchtungsstärke durch drei getrennte Kurven dargestellt werden, eine für jede Lichtquelle.

Abb. 3 Relative Sehleistung und relative Melatoninsuppression durch Licht für drei verschiedene Leuchtstofflampen (unter der Annahme der Funktion in Abb. 2) als eine Funktion der Beleuchtungsstärke am Auge
Abb. 3 zeigt, dass sich die spektralen Funktionen der im Bauwesen üblicherweise benutzten konventionellen Leuchtstofflampen in ihrem Einfluss auf die Melatoninsuppression nur wenig unterscheiden. Das ist nicht weiter überraschend, da die spektrale Verteilung des Lichts dieser Lampen zur Optimierung ihrer visuellen Wirkung (Helligkeit, Farbe) ausgewählt worden sind und nicht für die Wirkung auf das circadiane System. Es ist zu erwarten, das neue farbige Lichtquellen entwickelt werden können mit maximaler Lichtausbeute im kurzwelligen Bereich zur Maximierung der circadianen Wirkung bzw. im langwelligen Bereich, um diese zu minimieren. Man betrachte beispielsweise ein blaues LED (460 nm im Maximum) und ein rotes LED (630 nm im Maximum), die die gleiche photopische Beleuchtungsstärke liefern. Die relative Wirkung der zwei Quellen für das circadiane System unterscheidet sich ungefähr im Verhältnis 1200:1! Das bedeutet, dass für die Entwicklung neuer Lichtquellen ein neues photometrisches System benötigt wird, womit deren Wirkungen auf das circadiane System angemessen beschrieben werden können.
Räumliche Verteilung
Durch optische Brechung in der Hornhaut und der Linse des Auges und durch neuro-optische Verbesserungen durch die Retina [48] kann die räumliche Verteilung von Objekten und Texturen in der Umgebung durch das visuelle System verarbeitet werden. Eine ausreichend genaue Bewertung der Verteilung von Licht in unserer Umgebung durch die Retina ist überlebenswichtig, weil bestimmte Muster von Hell und Dunkel helfen, Freund und Feind zu unterscheiden. Eine genaue Erfassung der räumlichen Verteilung scheint für das circadiane System jedoch nicht bedeutsam zu sein. Die Phototransduktion von Licht durch das circadiane System scheint ohne Erfassung der räumlichen Verteilung abzulaufen, und die Retina dient als einfacher Integrator von absorbierten Photonen. In verschiedenen Studien wurden unterschiedliche Wege begangen, um Licht auf die Netzhaut zu bringen. In manchen Studien wurden Deckenleuchten mit Leuchtstofflampen in Räumen mit hellen Wänden benutzt [40], in anderen wurde monochromatisches Licht im „Ganzfeld“ dargeboten [41, 42], bei manchen wurden Leuchttische eingesetzt [30, 43], und in weiteren wiederum Lichtkästen in unterschiedlichen Positionen [37, 38, 49]. Trotz dieser sehr unterschiedlichen Methoden für die Darbietung von Licht ergeben die Studien ( unter Berücksichtigung von Timing, Dauer, Spektrum und Quantität des Lichts ) übereinstimmende Ergebnisse, aus denen man ableiten kann, dass die circadiane Aktivierung durch die simple Integration des Lichtflusses auf die Netzhaut bestimmt wird. Es muss jedoch bemerkt werden, dass es Anhaltspunkte dafür gibt, dass in der oberen und unteren Netzhaut unterschiedliche Dichte von Empfängern für das circadiane System vorliegen können. Zwei unabhängige Studien [50, 51] haben berichtet, dass die untere Netzhaut, die das oberhalb der Sehachse einfallende Licht integriert, für die Melatoninsuppression wichtiger ist als die obere Netzhaut. Allerdings war die Differenz nur in einer der beiden Studien statistisch signifikant [50]. Es muss auch bemerkt werden, dass Gesichtsmerkmale das Licht, das die Netzhaut erreicht, beeinflussen [32], und dass große persönliche Unterschiede in der Transmission des Lichts durch die Augenmedien zu erwarten sind, insbesondere bei älteren Personen, bei denen die Opazität der Augenlinse für kurze Wellenlängen größer ist [52]. Allgemein kann man aber annehmen, dass der spektral korrigierte Lichteinfall am Auge ein praktisches, wenn auch ungenaues Maß für das Licht darstellt, das dem circadianen System zur Verfügung steht.
Timing
Obwohl es geringe tageszeitliche Veränderungen in der visuellen Empfindlichkeit des Auges gibt, ist die Tageszeit für das Sehen und damit auch für die konventionelle Photometrie unwichtig. Die Tageszeit bezogenen Merkmale des Lichts sind aber besonders bedeutsam für das circadiane System und müssen daher bei jeglicher Art circadianer Photometrie berücksichtigt werden. Je nach Einwirkungszeitpunkt kann Licht die biologische Uhr vor- oder zurücksetzen oder unbeeinflusst lassen. Abb. 4 [54] zeigt, wie Lichtexposition den zeitlichen Verlauf der biologischen Uhr beeinflusst. Wenn Licht in der ersten Hälfte der Nacht zur Einwirkung kommt, wird die biologische Uhr zu einer späteren Zeit verschoben (verzögerte Phasenlage), während dasselbe Licht, angewendet in der zweiten Nachthälfte, die Uhr auf eine frühere Zeit verschiebt. Die größten Phasenverschiebungen werden in der Nacht eintreten, wenn die Melatoninspiegel hoch sind, geringere Wirkungen können aber auch während des Tages auftreten, wenn die Melatoninspiegel am niedrigsten sind. In der Tat scheint es, als wenn Melatoninsuppression und Phasenverschiebung durch Licht ähnlichen, aber nicht identischen Regeln gehorchen.

Abb. 4 Der Einfluss des Einwirkungszeitpunktes einer Lichtanwendung auf die Phasenverschiebung der Körperkerntemperatur für zwei Lichtniveaus [54]
Wie auch die Melatoninsuppression, folgt die Phasenverschiebung auch einer Dosis-Wirkungsfunktion, wobei die stärksten Effekte bei einer Lichteinwirkung in der zweiten Hälfte der Nacht eintreten. Abb. 4 zeigt die Wirkung sowohl hoher als auch niedriger Lichtniveaus auf die Phasenverschiebung des circadianen Systems. Es bleibt allerdings unklar, wie die Lichtintegration über die 24-Stundenperiode erfolgt, wenn Lichteinwirkung sowohl zu einer positiven als auch negativen Phasenverschiebung führt. Manche Autoren haben zu bedenken gegeben, dass helles Licht in der Nacht oder eine dunkle Umgebung bei Tage das circadiane System außer Tritt bringen, biologische Systeme desynchronisieren und so zur Schwächung der Immunreaktionen und sogar zu Brustkrebs führen kann [55]. Fortwährender, aber nicht periodischer Zugang zu Licht durch den Menschen innerhalb der 24-Stundenperiode stellt einen berechtigten Grund für Sorge und systematische Forschung dar.
Dauer
Das visuelle System arbeitet sehr schnell. Wenn es dies nicht tun würde, könnten Gefahren nicht vermieden und Gelegenheiten nicht ergriffen werden. Fast alle visuellen Reaktionen werden übermittelt durch neuronale Schaltkreise, die die Information über die visuelle Umgebung integrieren, kategorisieren und dem Gehirn übermitteln, das seinerseits eine Verhaltensreaktion in weniger als wenigen hundert Millisekunden einleitet [56]. Das circadiane System arbeitet hingegen sehr viel langsamer, insbesondere, weil die Kommunikation mit den verschiedenen Systemen des Körpers auf der Ausschüttung des Hormons Melatonin in den Blutkreislauf beruht und nicht auf neuronalen Schaltkreisen.

Abb. 5 Die benötigte Zeit für die nächtliche Melatoninsuppression durch Licht als Funktion des dem Auge zur Verfügung gestellten Lichts [16]. Die Vierecke zeigen 25% Suppression, die Dreiecke 40% und die Kreise 50%. Ausgefüllte Symbole aus McIntyre et al. [37], nicht ausgefüllte aus McIntyre et al. [38].
Kurze helle Lichtpulse von 5 s Länge bewirken nachweisbare Effekte auf die Melatoninsuppression bei Nagern [57], und die Dauer für die Nachweis von Melatonin im Blut lag bei zwei Minuten. Bei Menschen wurde Melatoninsuppression durch Licht in 10 Minuten messbar [12], und die Rückkehr zu nächtlichen Werten nach Ausschalten des Lichts wird nach mindestens 15 Minuten erfolgen [37, 38]. Melatoninproben im Blut wurden nicht in kürzeren Intervallen erhoben, es ist aber wahrscheinlich, dass Änderungen vom Melatoninspiegel im Blutkreislauf nicht unmittelbar erfolgen, auch wenn das neuronale Signal vom SCN zur Zirbeldrüse sehr schnell erfolgt, da die Diffusion von Melatonin ins Blut mehrere Minuten dauert.
Die Ergebnisse von McIntyre et al. [37, 38] zeigen, dass helle Lichtpulse eine schnellere Melatoninsuppression hervorrufen als dunklere. Abb. 5 [16] zeigt für drei unterschiedliche Niveaus von Melatoninsuppression (25%, 40% und 50%) die Beziehung zwischen der Beleuchtungsstärke am Auge und dem Zeitpunkt der Melatoninwirkung. Die Daten stammen von zwei unabhängigen Studien [37, 38], fallen aber bemerkenswert konsistent aus, wie es auch bei anderen Studien der Fall war [12, 58]. Eine Melatoninsuppression von 25% konnte in weniger als 20 Minuten erreicht werden, wenn die Beleuchtungsstärke auf dem Auge mehr als 1.000 lx betrug. Wenn das Niveau unter 500 lx gesenkt wurde, dauerte dies bis zu einer Stunde. Es scheint auch klar erkennbar zu sein, dass bei geringeren Beleuchtungsstärken als 200 lx am Auge die Melatoninsuppression nie über 25% liegen kann, unabhängig von der Expositionsdauer. Was man wissen müsste, aber ein Geheimnis geblieben ist, ist die Frage, wie viel Melatonin gebraucht wird und wie lange, um die biologischen Systeme zu aktivieren, die auf Melatonin im Blut reagieren.
Bezüglich der Phasenverschiebung hat eine Studie aus jüngster Vergangenheit gezeigt, dass ein 6,5 Stunden langer Puls von hellem Licht (9.500 lx am Auge) den gleichen Effekt verursacht wie sechs Pulse von 15 Minuten Dauer mit einer stündlichen Folge und der gleichen Beleuchtungsstärke [59]. Diese Daten zeigen, dass eine Phasenverschiebung auch bei niedrigen Niveaus von Melatoninsuppression eintreten kann. Der mittlere Melatoninspiegel wurde während der 6,5 Stunden mit dem kontinuierlichen Lichtpuls von 9.500 lx etwa um 90% abgesenkt, während die unterbrochenen Pulse zu weniger als 20% geführt haben. Diese Ergebnisse zeigen, dass man wirksame Phasenverschiebungseffekte erzielen könnte, ohne dass der Melatoninpegel verändert wird. Wenn die Erhaltung der Melatoninzyklen aus gesundheitlicher Sicht vorteilhaft sein sollte, kann man mit unterbrochenen Lichtpulsen einen Phasenverschiebungseffekt bei Schichtarbeitern hervorrufen.
Schlussfolgerungen
Also: „Versorgen wir unsere Büros, Schulen und Wohnräumen mit gesundem Licht?“. Die Antwort wird vermutlich lauten, „Nein, das tun wir nicht“. Mit Sicherheit stellen wir nicht die idealen Lichtsysteme und Anwendungen für die circadiane Steuerung zur Verfügung, wir beschreiben sie auch nicht. Aber wie werden wir wissen, welche Technologien und Anwendungen ideal sind, wenn wir nicht anfangen, die grundlegend wichtigen Eigenschaften von Licht in gänzlich neuer Art zu messen und steuern?
Ich hoffe, dass diese kurze Übersicht der Wirkungen des Lichts auf das circadiane System die Bedeutung der Entwicklung eines neuen Rahmenwerks für eine circadiane Photometrie unterstreicht. Tabelle 2 [16] fasst einige der wichtigsten Erkenntnisse zusammen, die in diesem Beitrag dargestellt werden und stellt die Unterschiede zwischen dem Lichtbedarf für das Sehen und für das circadiane System gegenüber. Die Menge des Lichts, seine spektrale Zusammensetzung, räumliche Verteilung sowie Zeitpunkt und Dauer, die für das Sehvermögen erforderlich sind, unterscheiden sich derart von den Anforderungen, die sich aus circadianen Funktionsweisen ergeben, dass man künftig allgemeine Empfehlungen über „gutes Licht“ nach zwei Kriteriensätzen treffen muss. Obwohl das in diesem Beitrag beschriebene Rahmenwerk zweifellos durch weitere Forschungsarbeiten verfeinert wird, wird nur ein geringer Fortschritt dabei erzielt werden, der Gesellschaft „Gesundes Licht“ bereit zu stellen, bis Wissenschaftler und Praktiker anfangen, die grundlegenden Eigenschaften von Licht sowohl nach den relevanten Aspekten für das circadiane System als auch für das visuelle System zu betrachten, zu messen, zu berechnen und zu steuern. Ich bin der Überzeugung, dass ein neues System für Photometrie auf der Basis des circadianen Systems entwickelt werden sollte.
| Eigenschaften des Lichts |
Anwendung Sehen |
Circadian, Schichtarbeit bei Tage |
Circadian, Schichtarbeit, nachts |
| Quantität | Gering (300-500 lx auf Sehaufgabe, 100 lx am Auge) |
Hoch (>1.000 lx am Auge)[37,30] |
Hoch (>1.000 lx am Auge) )[37,30] |
| Spektrum |
Photopisch (max. Empfindlichkeit bei 555 nm) |
Kurzwellig (max. Empfindlichkeit bei 420-480 nm) [30, 41- 47] |
Kurzwellig (max. Empfindlichkeit bei 420-480 nm) [30, 41- 47] |
| Räumliche Verteilung |
Verteilung bedeutsam (Leuchtdichte des Sehobjekts, Kontrast und Größe bestimmen die Sichtbarkeit) |
Unabhängig von der Verteilung (Beleuchtungsstärke am Auge) |
Unabhängig von der Verteilung (Beleuchtungsstärke am Auge) |
| Timing |
Jederzeit | Subjektiver „Morgen“ [54] |
Periodisch über die Schicht 7,56 |
| Dauer | Sehr kurz (< 1 s) | Lang (1 –2 h)[40] | Kurz (Pulse 15 Minuten) [50] |
Tabelle 2. Der Rahmen für die Berücksichtigung der Eigenschaften von Licht für visuelle und circadiane Funktionen [16]
Ich bin der Überzeugung, dass ein neues System für Photometrie auf der Basis des circadianen Systems entwickelt werden sollte, und dass wir bis zu dessen Realisierung nicht in der Lage sind, Anspruch an „gutes Licht“ mit Bezug auf die menschliche Gesundheit zu erheben. Dieses Symposium ist ein sehr wichtiger Schritt auf dem Wege zu diesem Ziel.
Literatur
1. Rea MS (ed.). 2000. IESNA Lighting Handbook: Reference and Application, 9th ed. New York: Illuminating Engineering Society of North America.
2. Commission International de l’Éclairage. 1978. Light As a True Visual Quantity: Principles of Measurement. Paris: Commission Internationale de l’Éclairage.
3. Lewy AJ, Kern HA, Rosenthal NE, Wehr TA. 1982. Bright artificial light treatment of a manic-depressive patient with seasonal mood cycle. Am J Psychiatry 139(11): 1496-1498.
4. Lack L, Wright H. 1993. The effect of evening bright light in delaying the circadian rhythms and lengthening the sleep of early morning awakening insomniacs. Sleep 16(5): 436-443.
5. Van Someren EJW, Kessler A, Mirmirann M, Swaab DF. 1997. Indirect bright light improves circadian rest-activity rhythm disturbances in demented patients. Biol Psychiatry 41: 55-963.
6. Boyce P, Beckstead JW, Eklund NH, Strobel RW, Rea MS. 1997. Lighting the graveyard shift: The influence of a daylight-simulating skylight on the task performance and mood of nightshift workers. Light Res Technol 29(3): 105- 134.
7. Figueiro MG, Rea MS, Boyce P, White R, Kolberg K. 2001. The effects of bright light on day and night shift nurses’ performance and well-being in the NICU. Neonatal Intens Care 14(1): 29-32.
8. Miller CL, White R, Whitman TL, O’Callaghan MF, Maxwell SE. 1995. The effects of cycled versus noncycled lighting on growth and development in preterm infants. Infant Behav Develop 18(1): 87-95. 9. Brandon DH, Holditch-Davis D, Belyea M. 2002. Preterm infants born at less than 31 weeks‘ gestation have improved growth in cycled light compared with continuous near darkness. J Pediatr 140(2): 192-199.
10. Berson DM, Dunn FA, Takao M. 2002. Phototransduction by retinal ganglion cells that set the circadian clock. Science 295(5557): 1070-1073.
11. Hattar S, Liao HW, Takao M, Berson DM, Yau KW. 2002. Melanopsincontaining retinal ganglion cells: architecture, projections, and intrinsic photosensitivity. Science 295(5557): 1065-1070.
12. Lewy AJ, Wehr TA, Goodwin FK, Newsome DA, Markey SP. 1980. Light suppresses melatonin secretion in humans. Science 210(4475): 1267-1269.
13. Dauchy RT, Blask DE, Sauer LA, Brainard GC, Krause JA. 1999. Dim light during darkness stimulates tumor progression by enhancing tumor fatty acid uptake and metabolism. Cancer Lett 144: 131-136.
14. Blask D, Sauer L, Dauchy R, Holowachuk E, Ruhoff M, Kopff H. 1999. Melatonin inhibition of cancer growth in vivo involves suppression of tumor fatty acid metabolism via melatonin receptor-mediated signal transduction
events. Cancer Res 59: 4793-4701.
15. Badia P, Myers B, Boecker M, Culpepper, J. 1991. Bright light effects on body temperature, alertness, EEG and Behavior. Physiol Behav 50(3): 583- 588.
16. Rea MS, Figueiro MG, Bullough JD. 2002. Circadian photobiology: An emerging framework for lighting practice and research. Light Res Technol 34(3): 177-190.
17. Withrow RB (ed.). 1957. Photoperiodism. Washington, DC: American Association for the Advancement of Science.
18. Nelson RJ, Zucker I. 1981. Absence of extraocular photoreception in diurnal and nocturnal rodents exposed to direct sunlight. Comp Biochem Physiol 69A: 145-148.
19. Wehr T, Schwartz P, Turner E, Feldman-Naim S, Drake C, Rosenthal N. 1995. Bimodal patterns of human melatonin secretion consistent with twooscillator model of regulation. Neurosci Lett 194: 105-108.
20. Monk TH, Buysse DJ, Reynolds CF, Berga SL, Jarrett DB, Kupfer DJ. 1997. Circadian rhythms in human performance and mood under constant conditions. J Sleep Res 6(1): 9-18.
21. Lockley S, Skene D, Thapan K, English J, Ribeiro D, Haimov I, Hampton S, Middleton B, von Schantz M, Arendt J. 1998. Extraocular light exposure does not suppress plasma melatonin in humans. J Clin Endocrinol Metab 83(9): 3369-3372.
22. Yamazaki S, Goto M, Menaker M. 1999. No evidence for extraocular photoreceptors in the circadian system of the Syrian hamster. J Biol Rhythms 14(3): 197-201.
23. Eastman CI, Martin SK, Hebert M. 2000. Failure of extraocular light to facilitate circadian rhythm reentrainment in humans. Chronobiol Int 17(6): 807-826.
24. Lindblom N, Hatonen T, Laasko M, Alila-Johansson A, Laipio M, Turpeinen U. 2000. Bright light exposure of a large skin area does not affect melatonin or bilirubin levels in humans. Biol Psychiatry 48(11): 1098-1104.
25. Koorengevel KM, Gordijn MC, Beersma DG, Meesters Y, den Boer JA, van der Hoofdakken RH, Daan S. 2001. Extraocular light therapy in winter depression: A double-blind placebo-controlled study. Biol Psychiatry 50(9): 691-698.
26. Lushington K, Galka R, Sassi LN, Kennaway DJ, Dawson D. 2002. Extraocular light exposure does not phase shift saliva melatonin rhythms in sleeping subjects. J Biol Rhythms 17(4): 377-386.
27. Pevet P, Nothorel B, Slotten H, Saboureau M. 2002. The chronobiotic properties of melatonin. Cell Tissue Res 309(1): 183-191.
28. Kalsbeek A, Buijs RM. 2002. Output pathways of the mammalian suprachiasmatic nucleus: Coding circadian timing by transmitter selection and specific targeting. Cell Tissue Res 309(1): 109-118.
29. Kronauer RE, Forger DB, Jewett ME. 1999. Quantifying human circadian pacemaker response to brief, extended and repeated light stimuli over the phototopic range. J Biol Rhythms 14(6): 500-515.
30. Rea MS, Bullough JD, Figueiro MG. 2001. Human melatonin suppression by light: A case for scotopic efficiency. Neurosci Lett 299(1-2): 45-48.
31. Brainard GC, Hanifin JP, Rollag MD, Greeson J, Byrne B, Glickman G, Gerner E, Sanford B. 2001. Human melatonin regulation is not mediated by the three cone photopic visual system. J Clin Endocrinol Metab 86(1): 433- 436.
32. Van Derlofske J, Bierman A, Rea MS, Ramanath J, Bullough JD. 2002. Design and optimization of a retinal flux density meter. Meas Sci Technol 13(6): 821-828.
33. Rea MS, Ouellette MJ. 1991. Relative visual performance: A basis for application. Light Res Technol 23(3): 135-144.
34. Weston HC. 1935. The relation between illumination and industrial efficiency: The effect of size of work. Joint Report of the Industrial Health Research Board and the Illumination Research Committee. London: His
Majesty’s Stationary Office.
35. Weston HC. 1945. The relation between illumination and industrial efficiency: The effect of brightness contrast. Industrial Health Research Board of the Medical Research Council, Report 87. London: His Majesty’s
Stationary Office.
36. Eklund NH, Boyce PR, Simpson SN. 2001. Lighting and sustained performance: modeling data-entry task performance. J Illum Eng Soc 30(2): 126-141.
37. McIntyre IM, Norman TR, Burrows GD, Armstrong SM. 1989. Human melatonin suppression by light is intensity dependent. J Pineal Res 6(2): 149-156.
38. McIntyre IM, Norman TR, Burrows GD, Armstrong SM. 1989. Quantal melatonin suppression by exposure to low intensity light in man. Life Sci 45(4): 327-332.
39. Brainard GC, Lewy AJ, Menaker M, Fredrickson RH, Miller LS, Weleber RG, Cassone V, Hudson D. 1988. Dose-response relationship between light irradiance and the suppression of plasma melatonin in human volunteers. Brain Res 454(1-2): 212-218.
40. Zeitzer JM, Dijk DJ, Kronauer R, Brown E, Czeisler C. 2000. Sensitivity of the human circadian pacemaker to nocturnal light: melatonin phase resetting and suppression. J Physiol 526(Pt. 3): 695-702.
41. Brainard GC, Hanifin JP, Greeson JM, Byrne B, Glickman G, Gerner E, Rollag MD. 2001 Action spectrum for melatonin regulation in humans: Evidence for a novel circadian photoreceptor. J Neurosci 21(16): 6405-6412.
42. Thapan K, Arendt J, Skene DJ. 2001. An action spectrum for melatonin suppression: evidence for a novel non-rod, non-cone photoreceptor system in humans. J Physiol 535(Pt. 1): 261-267.
43. Rea MS, Bullough JD, Figueiro MG. 2002. Phototransduction for human melatonin suppression. J Pineal Res 32(4): 209-213.
44. Lechner NM. 1987. The daylighting department. Arch Lighting 1: 47-49.
45. Rosen LN, Targum SD, Terman M, Bryant MJ, Hoffman H, Kasper SF, Hamovit JR, Docherty JP, Welch B, Rosenthal NE. 1990. Prevalence of seasonal affective disorder at four latitudes. Psychiatry Res 31(2): 131-144.
46. Smith SW, Rea MS. 1980. Relationships between office task performance and ratings of feelings and task evaluations under different light sources and levels. Proc 19th Sess Commission Internationale de l’Éclairage Kyoto, Japan: Commission Internationale de l’Éclairage.
47. Sekuler R, Blake R. 1994. Perception. New York: McGraw-Hill.
48. Hofer H, Williams DR. 2002. The eye’s mechanisms for auto-calibration. Opt Photon News 13(1): 34-39.
49. Adler JS, Kripke DF, Loving RT, Berga SL. 1992. Peripheral vision suppression of melatonin. J Pineal Res 12(2): 49-52.
50. Lasko TA, Kripke DF, Elliot JA. 1999. Melatonin suppression by illumination of upper and lower visual fields. J Biol Rhythms 14(2): 122- 125.
51. Visser EK, Beersma DG, Daan S. 1999. Melatonin suppression by light in humans is maximal when the nasal part of the retina is illuminated. J Biol Rhythms 14(2): 116-121.
52. Weale RA. 1963. The Ageing Eye. London: HK Lewis and Company.
53. Terman M, Terman J. A circadian pacemaker for visual sensitivity? Ann NY Acad Sci 453: 147-161.
54. Boyce PR. 1997. Light, sight and photobiology. Lighting Futures 2: 1, 3-6.
55. Stevens RG, Rea MS. 2001. Light in the built environment: Potential role of circadian disruption in endocrine disruption and breast cancer. Cancer Cause Control 12(3): 279-287.
56. Ingling CR, Martinez E, Lewis AL. 1983. Tonic-phasic channel dichotomy and Crozier’s law. J Opt Soc Am 73: 183-189.
57. Reiter RJ. 1985. Action spectra, dose-response relationships, and temporal aspects of light’s effects on the pineal gland. Annal NY Acad Sci 453: 215- 230.
58. Aoki H, Yamada N, Ozeki Y, Yamane H, Kato N. 1998. Minimum light intensity required to suppress nocturnal melatonin concentration in human saliva. Neurosci Lett 252(2): 91-94.
59. Gronfier C, Kronauer RE, Wright KP, Czeisler CA. 2000. Phase-shifting effectiveness of intermittent light pulses: Relationship to melatonin suppression. 7th Meeting of the Society for Research on Biological Rhythms.
Jacksonville: Society for Research on Biological Rhythms.
Den gesamten illustrierten Beitrag können Sie hier als PDF-Datei einsehen.
